

Institut für
AK Agrarklimaschutz
Projekt
Regelung der Denitrifikation in Agrarböden
Bodeninkubationen zur Gewinnung von Modellvalidierungsdatensätzen und Experimente zur Quantifizierung des anaeroben Volumenanteils im Boden - Teilprojekt 6 der Forschergruppe "Denitrification in Agricultural Soils: Integrated control and Modelling at various scales“ (DASIM) (DFG FOR 2337)
Für eine genaue Vorhersage gasförmiger Stickstoffverluste aus Agrarböden durch mikrobielle Prozesse fehlen bislang robuste Messdaten zu N2-Emissionen und zur Sauerstoffverarmung im Boden. Unsere Aufgabe ist es, diese Lücke anhand von Laboruntersuchungen zu schließen.
Hintergrund und Zielsetzung
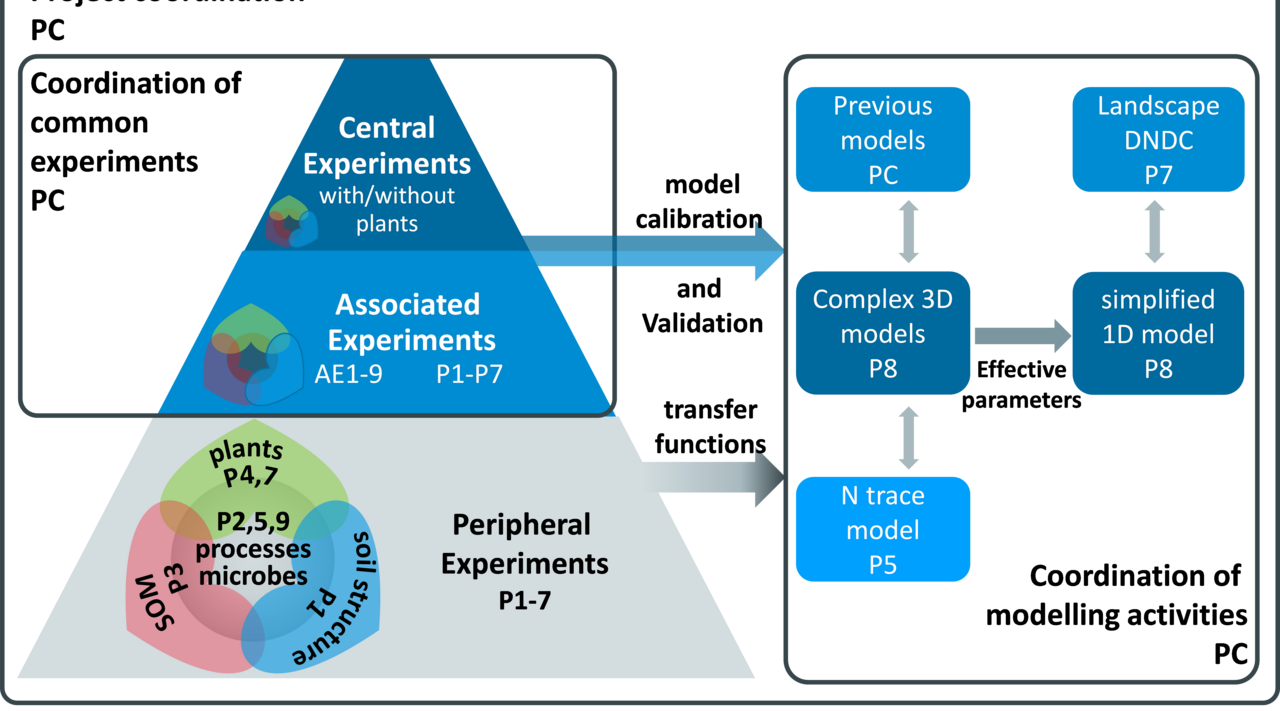
Denitrifikation ist ein anaerober mikrobieller Prozess der sukzessiven Reduktion von Nitrat (NO3-) und Nitrit (NO2-) zu molekularem Stickstoff (N2) mit folgenden Reaktionsschritten: NO3- → NO2- → NO → N2O → N2. Das Zwischenprodukt Lachgas (N2O) wird z.T. nicht weiter zu N2 reduziert. Die daraus resultierende Emission in die Atmosphäre stellt den dominanten Anteil der Emission dieses Klimagases aus landwirtschaftlichen Böden dar. Unser Verständnis und die Fähigkeit zur Quantifizierung der Denitrifikation im Boden ist eine entscheidende Voraussetzung, um den Verlust von Düngerstickstoff und N2O-Emissionen reduzieren zu können. Robuste Datensätze zur Validierung von N2-Flüssen aus Denitrifikationsmodellen sind rar, vor allem weil geeignete Methoden nur begrenzt verfügbar sind, aber auch wegen der extremen raum-zeitlichen Heterogenität der Denitrifikation. Die DFG-Forschergruppe „Denitrification in Agricultural Soils: Integrated Control and Modelling at Various Scales (DASIM)” (https://www.thuenen.de/de/ak/aktuelles-und-service/detail-aktuelles/news/detail/News/neue-dfg-forschergruppe-beschaeftigt-sich-mit-der-denitrifikation-in-agrarboeden/) beleuchtet mit analytischen und molekularbiologischen Methoden sowie mit Freiland-Experimenten und verschiedenen Modellansätzen die Prozesskette der Denitrifikation in Agrarböden von der Mikroskala zur Feldskala. Ziel ist es, die Aktivität und Regelung der Denitrifikation mit einer bisher beispiellosen räumlichen und zeitlichen Auflösung zu untersuchen, um anhand der Ergebnisse mathematische Modelle von der Mikroskala zur Feldskala zu entwickeln und vorhandene Simulationsmodelle zu verbessern. Der anaerobe Volumenanteil im Boden, eine wesentliche Steuergröße der Denitrifikation, ist bekanntlich von der räumlichen Verteilung der Gasdiffusivität und der Respiration abhängig. Durch die begrenzte Messbarkeit seiner Regelfaktoren wurde der anaerobe Volumenanteil im Boden bisher kaum quantifiziert. Heute stehen jedoch besser geeignete Methoden zur Verfügung.
Unsere Ziele im Teilprojekt P6 sind:
- Quantifizieren von N2-, N2O- und NO- Emissionen
- Quantifizieren des Beitrags der verschiedenen N-Transformationen unter variablem Einfluss von Kontrollfaktoren der Denitrifikation (organischer Kohlenstoff, mineralischer Stickstoff, Wassergehalt, Porenvolumen)
- und darauf basierend die Validierung von bestehenden Denitrifikationsmodellen (durch unsere Projektpartner).
- Erstellen von Datensätzen, die so detailliert wie möglich Raten und Typen der N2 und N2O produzierenden Prozesse abbilden sowie ihre physikalischen, chemischen und mikrobiellen Regelfaktoren (in Kooperation mit unseren Projektpartnern)
- darauf basierend die Kalibrierung und Validierung der in DASIM neu entwickelten Modelle (durch unsere Projektpartner).
- Bestimmen des repräsentativen Elementarvolumens für N2- und N2O-Emissionen aus Ackerböden.
- Bestimmen des anaeroben Volumenanteils in den untersuchten Böden unter variablen Bedingungen.
- Visualisieren, wie die organische Bodensubstanz an ausgewählten Bodenproben auf der Mikroskala verteilt ist.
- Prüfung an ausgewählten Bodenproben, ob eine mikro-skalige Lokalisierung der Denitrifikation durchführbar ist.
Vorgehensweise
Unsere Ziele erreichen wir in vier Abschnitten:
- Um Datensätze zu erheben, die die Aktivität der Denitrifikation und ihre Regelung in hoher räumlicher und zeitlicher Auflösung abbilden, setzen wir neue und verbesserte Stabilisotopenmethoden ein. Die Datensätze dienen der Validierung bestehender und der Kalibrierung neuer Denitrifikationsmodelle, die in anderen Teilprojekten von DASIM angewendet und/oder entwickelt werden.
- Durch Inkubationsversuche mit variierter Bodenmenge unter standardisierten Bedingungen untersuchen wir das für die Denitrifikation repräsentative Elementarvolumen. Auf dieser Grundlage können unsere Projektpartner die Modellierung skalieren.
- Um den anaeroben Bodenvolumenanteil zu bestimmen, messen wir in Kooperation mit anderen Teilprojekten die räumliche Verteilung der Gasdiffusivität sowie der Denitrifikationsaktivitäten unter definierten Sauerstoffverhältnissen. Diese verschiedenen Ansätze werden kreuzvalidiert. Der aussichtsreichste wird bei der Validierung des anaeroben Volumens in den neuen Denitrifikationsmodellen Anwendung finden.
- Wir testen, ob die räumlichen Verteilungen der Denitrifikationsaktivität und ihrer Kontrollfaktoren mit NanoSIMS bestimmt werden können, und ob die nano-skalige Sekundärionen-Massenspektrometrie (NanoSIMS) geeignet ist, um in Phase 2 von DASIM heterogene mikroskalige Prozesse in größerem Umfang zu untersuchen. Diese Tests beinhalten die Messung der Verteilung der organischen Substanz in ausgewählten Bodenaggregaten und eine neue 15N-Tracermethode zur Lokalisierung von Nitratabbau in Aggregaten.

Unsere Forschungsfragen
Die in der gesamten Forscherguppe DASIM behandelten Fragen sind:
- Wie wird die Aktivität von denitrifizierenden Mikroorganismen und die Struktur ihrer Gemeinschaft auf der Mikroskala geregelt?
- Wie wird die Denitrifikation durch andere zeitgleich ablaufende N-Transformationen beeinflusst?
- Was bestimmt die Bildung von “hot spots” (d.h. Habitate höchster Aktivität) und “hot moments” (d.h. zeitliche hot spots) der Denitrifikationsaktivität?
- In welchem Ausmaß ist die Regelung der Denitrifikation abhängig von der betrachteten Skala (z.B. Mikro-, Meso- oder Feldskala)?
- Kann die Denitrifikation für einen gegebenen Boden unter bestimmten atmosphärischen Randbedingungen anhand von messbaren strukturellen und biochemischen Eigenschaften vorhergesagt werden?
Die in unserem Teilprojekt P6 behandelten Fragen sind:
- Wie werden die Emissionen von N2, N2O und NO und ihre Interaktion mit den verschiedenen N-Transformationen von physikalischen, chemischen und mikrobiellen Regelfaktoren beeinflusst?
- Welche Größe hat das repräsentativen Elementarvolumens für N2- und N2O-Emissionen aus Ackerböden.
- Wie kann der anaerobe Volumenanteil im Boden bestimmt werden und welchen Beitrag kann die Messung dieser Größe zur Verbesserung von Denitrifikationsmodellen beitragen?
- Wie ist die organische Bodensubstanz auf der Mikroskala verteilt und welchen Beitrag kann die Messung dieser Größe zur Verbesserung von Denitrifikationsmodellen beitragen?
- Können wir Denitrifikationsaktivität auf der Mikroskala mit Hilfe der nano-skaligen Sekundärionen-Massenspektrometrie (NanoSIMS) lokalisieren?
Ergebnisse
Publikationen:
Well R, Butterbach-Bahl K (2013) Comments on "A test of a field-based 15N-nitrous oxide pool dilution technique to measure gross N2O production in soil" by Yang et al. (2011), Global Change Biology, 17, 3577–3588. Global Change Biol 19:133-135, DOI:10.1111/gcb.12005
Loick N, Dixon ER, Abalos D, Vallejo A, Matthews GP, McGeough KL, Well R, Watson CJ, Laughlin RJ, Cardenas LM (2016) Denitrification as a source of nitric oxide emissions from incubated soil cores from a UK grassland soil. Soil Biol Biochem 95:1-7, DOI:10.1016/j.soilbio.2015.12.009
Harter J, Guzman-Bustamente I, Kuehfuss S, Ruser R, Well R, Spott O, Kappler A, Behrens S (2016) Gas entrapment and microbial N2O emissions from a biochar-amended sandy clay loam soil. Sci Rep 6:39574, DOI:10.1038/srep39574
Krause H-M, Thonar C, Eschenbach W, Well R, Mäder P, Behrens S, Kappler A, Gattinger A (2017) Long term farming systems affect soils potential for N2O production and reduction processes under denitrifying conditions. Soil Biol Biochem 114:31-41, DOI:10.1016/j.soilbio.2017.06.025
Wrage-Mönnig N, Horn MA, Well R, Müller C, Velthof G (2018) The role of nitrifier denitrification in the production of nitrous oxide revisited. Soil Biol Biochem 123:A3-A16, DOI:10.1016/j.soilbio.2018.03.020
Well R, Buchen C, Köster JR, Lewicka-Szczebak D, Rohe L, Senbayram M, Wu D (2019) A critique of the paper "Estimate of bacterial and fungal N2O production processes after crop residue input and fertilizer application to an agricultural field by 15N isotopomer analysis", by Yamamoto et al. (2017), Soil Biology & Biochemistry 108, 9–16. Soil Biol Biochem 135:450-451, DOI:10.1016/j.soilbio.2018.06.008
Senbayram M, Well R, Bol R, Chadwick DR, Jones DL, Wu D (2018) Interaction of straw amendment and soil NO3- content controls fungal denitrification and denitrification product stoichiometry in a sandy soil. Soil Biol Biochem 126:204-212, DOI:10.1016/j.soilbio.2018.09.005
Wu D, Wei Z, Well R, Shan J, Yan X, Bol R, Senbayram M (2018) Straw amendment with nitrate-N decreased N2O/(N2O+N2) ratio but increased soil N2O emission: A case study of direct soil-born N2 measurements. Soil Biol Biochem 127:301-304, DOI:10.1016/j.soilbio.2018.10.002
Well R, Burkart S, Giesemann A, Grosz BP, Köster JR, Lewicka-Szczebak D (2019) Improvement of the 15N gas flux method for in situ measurement of soil denitrification and its product stoichiometry. Rapid Comm Mass Spectrometry 33(5):437-448, DOI:10.1002/rcm.8363
Castellano-Hinojosa A, Loick N, Dixon E, Matthews GP, Lewicka-Szczebak D, Well R, Bol R, Charteris A, Cardenas LM (2019) Improved isotopic model based on 15N tracing and Rayleightype isotope fractionation for simulating differential sources of N2O emissions in a clay grassland soil. Rapid Comm Mass Spectrometry 33(5):449-460, DOI:10.1002/rcm.8374
Well R, Maier M, Lewicka-Szczebak D, Köster JR, Ruoss N (2019) Underestimation of denitrification rates from field application of the 15N gas flux method and its correction by gas diffusion modelling. Biogeosciences 16(10):2233-2246, DOI:10.5194/bg-16-2233-2019
Wu D, Well R, Cardenas LM, Fuß R, Lewicka-Szczebak D, Köster JR, Brüggemann N, Bol R (2019) Quantifying N2O reduction to N2 during denitrification in soils via isotopic mapping approach: Model evaluation and uncertainty analysis. Environ Res 179, Part A:108806, DOI:10.1016/j.envres.2019.108806
Thünen-Ansprechperson

Thünen-Beteiligte
Beteiligte externe Thünen-Partner
-
Technische Universität München
(München, Freising-Weihenstephan, Deutschland) -
Umweltforschungszentrum
(Halle (Saale), Deutschland) -
Leibniz Universität Hannover
(Hannover, Deutschland) -
Martin-Luther-Universität Halle-Wittenberg
(Halle (Saale), Deutschland) - Georg-August-Universität Göttingen
(Göttingen, Deutschland) -
Justus-Liebig-Universität Gießen
(Gießen, Deutschland) -
Universität Rostock
(Rostock, Deutschland) -
Karlsruher Institut für Technologie (KIT)
(Garmisch-Partenkirchen, Deutschland) -
Technical University of Clausthal
(Clausthal, Deutschland) -
Norwegian University of Life Sciences
(Ås, Norwegen)
Geldgeber
-
Deutsche Forschungsgemeinschaft (DFG)
(national, öffentlich)
Zeitraum
6.2016 - 5.2019
Weitere Projektdaten
Projektfördernummer: FOR 2337
Projektstatus:
abgeschlossen
Publikationen
- 0
Rummel PS, Well R, Pausch J, Pfeiffer B, Dittert K (2021) Carbon availability and nitrogen mineralization control denitrification rates and product stoichiometry during initial maize litter decomposition. Appl Sci 11(11):5309, DOI:10.3390/app11115309
- 1
Grosz BP, Well R, Dechow R, Köster JR, Khalil MI, Merl S, Rode A, Ziehmer B, Matson A, He H (2021) Evaluation of denitrification and decomposition from three biogeochemical models using laboratory measurements of N2, N2O and CO2. Biogeosciences 18(20):5681-5697, DOI:10.5194/bg-18-5681-2021
- 2
Lewicka-Szczebak D, Jansen-Willems A, Müller C, Dyckmans J, Well R (2021) Nitrite isotope characteristics and associated soil N transformations. Sci Rep 11:5008, DOI:10.1038/s41598-021-83786-w
- 3
Malghani S, Yoo G-y, Giesemann A, Well R, Kang H (2020) Combined application of organic manure with urea does not alter the dominant biochemical pathway producing N2O from urea treated soil. Biol Fertil Soils 56:331-343, DOI:10.1007/s00374-019-01420-4
- 4
Rummel PS, Pfeiffer B, Pausch J, Well R, Schneider D, Dittert K (2020) Maize root and shoot litter quality controls short-term CO2 and N2O emissions and bacterial community structure of arable soil. Biogeosciences 17:1181-1198, DOI:10.5194/bg-17-1181-2020
- 5
Well R, Buchen C, Köster JR, Lewicka-Szczebak D, Rohe L, Senbayram M, Wu D (2019) A critique of the paper "Estimate of bacterial and fungal N2O production processes after crop residue input and fertilizer application to an agricultural field by 15N isotopomer analysis", by Yamamoto et al. (2017), Soil Biology & Biochemistry 108, 9–16. Soil Biol Biochem 135:450-451, DOI:10.1016/j.soilbio.2018.06.008
- 6
Castellano-Hinojosa A, Loick N, Dixon E, Matthews GP, Lewicka-Szczebak D, Well R, Bol R, Charteris A, Cárdenas LM (2019) Improved isotopic model based on 15N tracing and Rayleightype isotope fractionation for simulating differential sources of N2O emissions in a clay grassland soil. Rapid Comm Mass Spectrometry 33(5):449-460, DOI:10.1002/rcm.8374
- 7
Well R, Burkart S, Giesemann A, Grosz BP, Köster JR, Lewicka-Szczebak D (2019) Improvement of the 15N gas flux method for in situ measurement of soil denitrification and its product stoichiometry. Rapid Comm Mass Spectrometry 33(5):437-448, DOI:10.1002/rcm.8363
- 8
Wu D, Well R, Cárdenas LM, Fuß R, Lewicka-Szczebak D, Köster JR, Brüggemann N, Bol R (2019) Quantifying N2O reduction to N2 during denitrification in soils via isotopic mapping approach: Model evaluation and uncertainty analysis. Environ Res 179(Part A):108806, DOI:10.1016/j.envres.2019.108806
- 9
Well R, Maier M, Lewicka-Szczebak D, Köster JR, Ruoss N (2019) Underestimation of denitrification rates from field application of the 15N gas flux method and its correction by gas diffusion modelling. Biogeosciences 16(10):2233-2246, DOI:10.5194/bg-16-2233-2019
- 10
Senbayram M, Well R, Bol R, Chadwick DR, Jones DL, Wu D (2018) Interaction of straw amendment and soil NO3- content controls fungal denitrification and denitrification product stoichiometry in a sandy soil. Soil Biol Biochem 126:204-212, DOI:10.1016/j.soilbio.2018.09.005
- 11
Wu D, Wei Z, Well R, Shan J, Yan X, Bol R, Senbayram M (2018) Straw amendment with nitrate-N decreased N2O/(N2O+N2) ratio but increased soil N2O emission: A case study of direct soil-born N2 measurements. Soil Biol Biochem 127:301-304, DOI:10.1016/j.soilbio.2018.10.002
- 12
Wrage-Mönnig N, Horn MA, Well R, Müller C, Velthof G (2018) The role of nitrifier denitrification in the production of nitrous oxide revisited. Soil Biol Biochem 123:A3-A16, DOI:10.1016/j.soilbio.2018.03.020
- 13
Krause H-M, Thonar C, Eschenbach W, Well R, Mäder P, Behrens S, Kappler A, Gattinger A (2017) Long term farming systems affect soils potential for N2O production and reduction processes under denitrifying conditions. Soil Biol Biochem 114:31-41, DOI:10.1016/j.soilbio.2017.06.025
- 14
Loick N, Dixon ER, Abalos D, Vallejo A, Matthews GP, McGeough KL, Well R, Watson CJ, Laughlin RJ, Cárdenas LM (2016) Denitrification as a source of nitric oxide emissions from incubated soil cores from a UK grassland soil. Soil Biol Biochem 95:1-7, DOI:10.1016/j.soilbio.2015.12.009
- 15
Harter J, Guzman-Bustamente I, Kuehfuss S, Ruser R, Well R, Spott O, Kappler A, Behrens S (2016) Gas entrapment and microbial N2O emissions from a biochar-amended sandy clay loam soil. Sci Rep 6:39574, DOI:10.1038/srep39574
- 16
Well R, Butterbach-Bahl K (2013) Comments on "A test of a field-based 15N-nitrous oxide pool dilution technique to measure gross N2O production in soil" by Yang et al. (2011), Global Change Biology, 17, 3577–3588. Global Change Biol 19:133-135, DOI:10.1111/gcb.12005





